Содержание
Прорыв в лечении бесплодия
30 октября 2013
Прорыв в лечении бесплодия
- 3914
- 2,8
- 2
- 1
Добавить в избранное
 Новость
Новость
Овуляция и дальнейшее оплодотворение возможны при наличии в яичниках женщины абсолютно жизнеспособных фолликулов
Автор
Редакторы
- «Био/мол/текст»-2013
- Биомолекулы
- Вопросы пола
- Медицина
- Мнения
- Тканевая инженерия
Статья на конкурс «био/мол/текст»: Процент женщин, лишенных радости материнства, с каждым годом возрастает. Среди причин бесплодия всё чаще выделяют первичную недостаточность яичников (ПНЯ). Данная патология заключается в отсутствии фолликулов или нарушении их созревания в ответ на гормональную стимуляцию. Решение проблемы эндокринного бесплодия вследствие синдрома истощения яичников предложили ученые из США и Японии. Им удалось активировать фолликулы яичников в условиях in vitro и имплантировать фрагменты ткани в верхний отдел фаллопиевых труб, что дает женщине шанс стать матерью.

Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Корни проблемы
Яичник — уникальная эндокринная система, в которой ежемесячно возникает новая секреторная структура — граафов фолликул (рис. 1). Он развивается из микроскопического примордиального фолликула, потенциальная функциональность которого и определяет регулярность менструального цикла женщины.
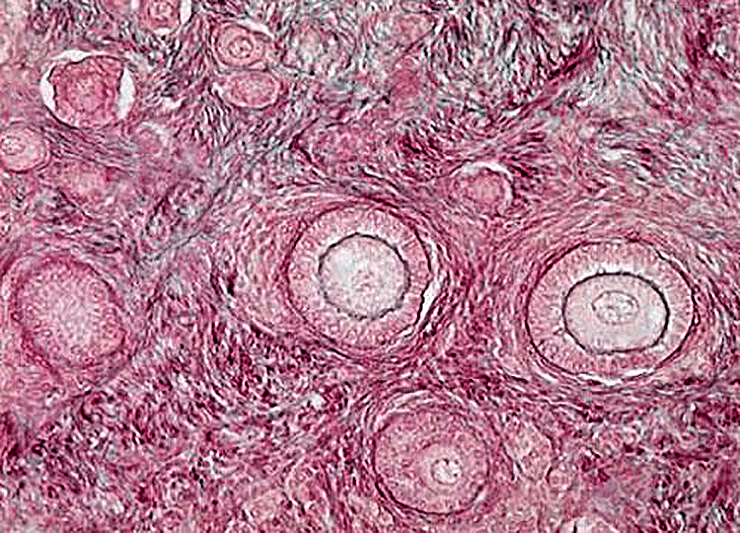
Рисунок 1. Фолликулы яичников
Функция яичников регулируется двумя гормонами гипофиза: фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) (рис. 2). В свою очередь, яичники продуцируют гормоны, регулирующие секрецию ФСГ и ЛГ по принципу отрицательной обратной связи: эстрогены, ингибины и прогестерон [1].
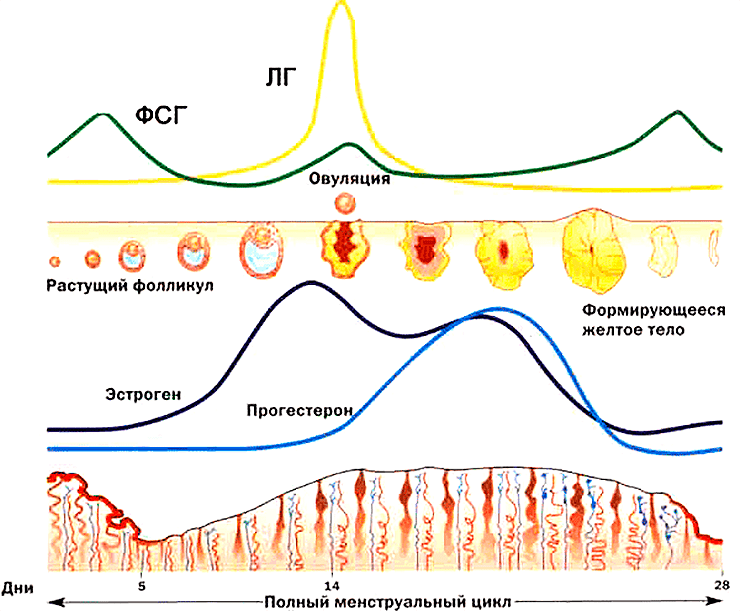
Рисунок 2. ФСГ стимулирует рост и созревание фолликула в яичнике. ЛГ стимулирует выход созревшей яйцеклетки из фолликула (овуляцию).
При недостаточности функции яичников для поддержания снижающейся концентрации яичниковых гормонов происходит резкое повышение секреции гонадотропинов. За их выработку отвечает гипоталамус (рис. 3).
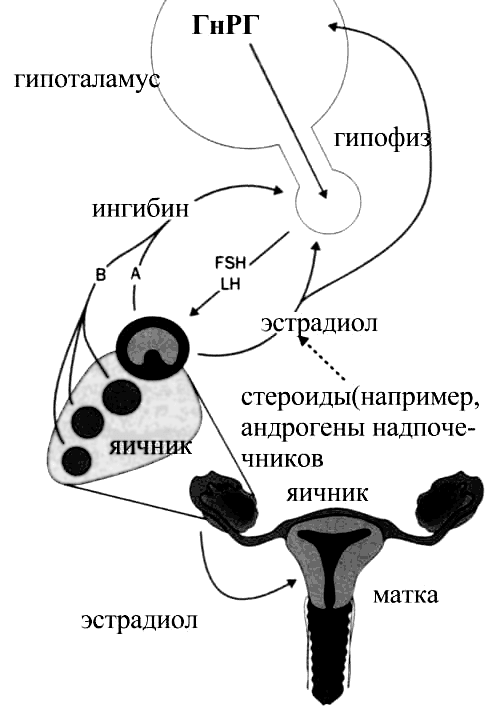
Рисунок 3. Связь функционирования яичников с эндокринной системой
Причины, приводящие к развитию первичной недостаточности яичников (ПНЯ), весьма гетерогенны: генетические, ферментативные, аутоиммунные, инфекционно-токсические, психогенные. Кроме того, в эту группу относят и дефекты в структуре гонадотропинов. В последние годы большое внимание исследователей уделяется молекулярно-генетическим аспектам этой патологии яичников, поскольку выявлен определенный набор генов, который может отвечать за развитие ПНЯ.
Стоит отметить, что термин «первичная недостаточность яичников» в настоящее время применяется для определения состояния, которое ранее называли «преждевременной менопаузой». Ключевое различие заключается в том, что термин «ПНЯ», предложенный еще в 1942 году, характеризует нарушение функции яичников в динамике, а не конечное состояние, что наблюдается при менопаузе [1].
Диагностика
Яичниковая недостаточность диагностируется по повышенному уровню ФСГ и ЛГ в крови при сниженном уровне эстрогенов. Самый чувствительный гормон — ФСГ; он является самым ранним маркером преждевременного старения яичников. При двукратном превышении уровня ФСГ (20 Ед/л) наступление и благополучный исход беременности маловероятны.
Клинические характеристики состояния: аменорея (отсутствие менструации) ≥4 месяцев у женщин моложе 40 лет, бесплодие и повышение уровня ФСГ до менопаузальных значений (дважды с промежутком не менее 1 месяца).
Частота спонтанной недостаточности яичников у женщин с хромосомным набором 46 ХХ составляет около 1%; при этом эпидемиологические исследования указывают на тесную связь данного нарушения с возрастом. Так, у женщин в возрасте до 20 лет ПНЯ встречается с частотой 1:10000, а в возрасте от 30 до 40 — 1:1000.
Что происходит на гормональном уровне
Один из половых гормонов — 17β-эстрадиол (рис. 4), который играет важную роль в выполнении репродуктивной функции женщины, — вырабатывается преимущественно в яичниках из мужских половых гормонов — андростендиона и тестостерона [2]; небольшое количество этого гормона также вырабатывается надпочечниками. В процессе угасания функций яичников количество растущих фолликулов в них уменьшается, что приводит к значительному понижению выработки 17β-эстрадиола. Поэтому у женщин с так называемым синдромом истощения яичников наблюдается нехватка этого гормона, которая частично компенсируется большей выработкой 17β-эстрадиола в надпочечниках. Так как менструации становятся нерегулярными, уровень 17β-эстрадиола начинает колебаться, и с прекращением менструаций резко понижается, что приводит к повышению фолликулостимулирующего гормона (ФСГ).

Рисунок 4. β-эстрадиол (кристаллы). Поляризация LM X100.
Механизм активации незрелых фолликулов
Для женщин, страдающих бесплодием по причине рассмотренного заболевания, существует единственная возможность материнства — имплантация оплодотворенной донорской яйцеклетки. Однако группа специалистов из Стэнфордского университета (США) и Медицинского факультета Университета им. Святой Марианны (Япония) предложили альтернативу — метод, позволяющий исключить известные хирургические вмешательства для стимуляции овуляции, такие как клиновидная резекция яичников или лазерное сверление. Врачи удалили яичники у участниц исследования, поделили их на несколько частей, а затем воздействовали на фрагменты яичников препаратами, стимулирующими рост. Спустя несколько дней некоторые из фрагментов ткани были имплантированы в фаллопиевы трубы женщин. Затем специалисты наблюдали за развитием фолликулов. У некоторых участниц исследования сформировались зрелые яйцеклетки, что позволило провести им стандартную процедуру экстракорпорального оплодотворения (ЭКО [3]). Результаты исследования опубликованы в журнале Proceedings of the National Academy of Sciences [4].
Важно отметить, что возможность провести подобное лечение возникла благодаря изучению сигнального клеточного пути под названием Hippo [5], который представляет собой один из ключевых компонентов регуляции таких важных процессов, как контактное ингибирование роста клеток и связанного с ним контроля размера внутренних органов [6]. Первоначально белковый комплекс Hippo был открыт у дрозофил. Мухи, у которых его функционирование было нарушено, буквально увеличивались в размерах (из-за чего регулятор и получил своё название: «Hippo» происходит от слова «гиппопотам»). Затем его обнаружили и у млекопитающих.
Ключевым компонентом пути Hippo является киназа Yap (Yes-activated protein), которая в активном состоянии способна связывать ряд факторов транскрипции, таких как p73, p53-binding protein-2 (p53BP2), RUNX2, SMAD7, ERBB4, PEBP2а и TEAD/ТЕF [7]. Регуляция активности YAP осуществляется в основном за счет ингибирующего действия киназ LATS1 и 2 (large tumor supressor-1 и −2). Они, в свою очередь, активируются киназами МSТ1 и МSТ2 (mammalian sterile-20-like kinases). Для полной активации LATS и МSТ необходимо также, чтобы они были связаны с адапторными белками WW45 и МОB1, соответственно. Вышеописанная часть сигнального пути Hippo является высококонсервативной у млекопитающих, в то время как сигналы активации или ингибирования LATS и МSТ могут быть достаточно разнообразными. В общих чертах сигнальный путь Hippo представлен на рис. 5.
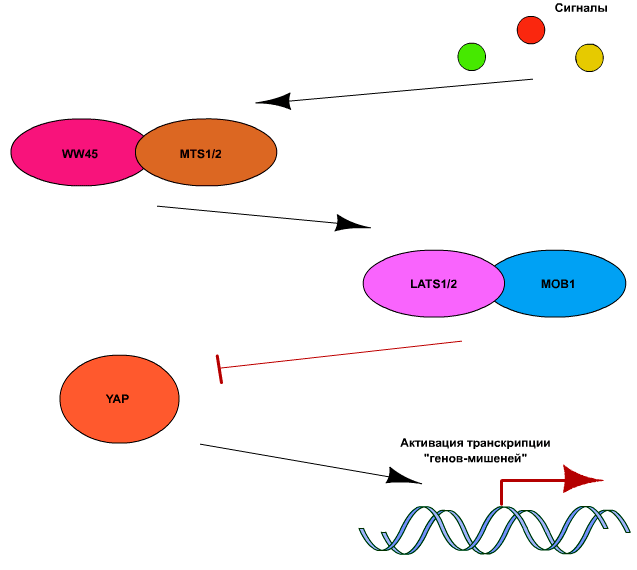
Рисунок 5. Схематичное изображение работы сигнального белкового регулятора Hippo
Развитие эмбриона, деление эмбриональных клеток и рост тканей и органов эволюционно контролируются работой различных регуляторов. По словам одного из авторов исследования Арона Сюэ (Aaron Hsueh) — акушера-гинеколога из Стэнфордского Университета в Калифорнии — у женщин с синдромом истощения яичников наблюдается повышенная активность регулятора Hippo [8]. Другими словами, он блокирует созревание практически всех фолликулов яичника, что минимизирует возможность наступления овуляции и дальнейшего оплодотворения.
Ученые нарушили работу сигнального пути Hippo в удаленных яичниках и, таким образом, предотвратили преждевременную остановку развития фолликулов. Далее специалисты стимулировали активность другого сигнального пути, называемого Akt, что способствовало ускорению роста фолликулов [9], [10].
Клинические исследования проводились сначала на лабораторных животных. На следующем этапе в эксперименте согласились принять участие 27 женщин, страдающих от первичной дисфункции яичников. В ходе исследования выяснилось, что у некоторых женщин в яичниках не было фолликулов. В яичниках 13 пациенток обнаружили незрелые фолликулы; из них у восьми женщин применение нового метода лечения способствовало росту жизнеспособных фолликулов. Для 14 женщин лечение оказалось неэффективным.
В результате зрелые яйцеклетки были получены у пяти женщин и использованы для ЭКО. Одна из пациенток в возрасте 29 лет во время курса лечения на 37 неделе беременности родила ребенка весом 3,3 кг (рис. 6). Научная группа надеется, что эффективность нового метода лечения достигнет 30%. И, более того, по их словам, этот метод может также помочь женщинам, перенесшим лучевую или химиотерапию, и пациенткам в возрасте лет с нерегулярным менструальным циклом [11].
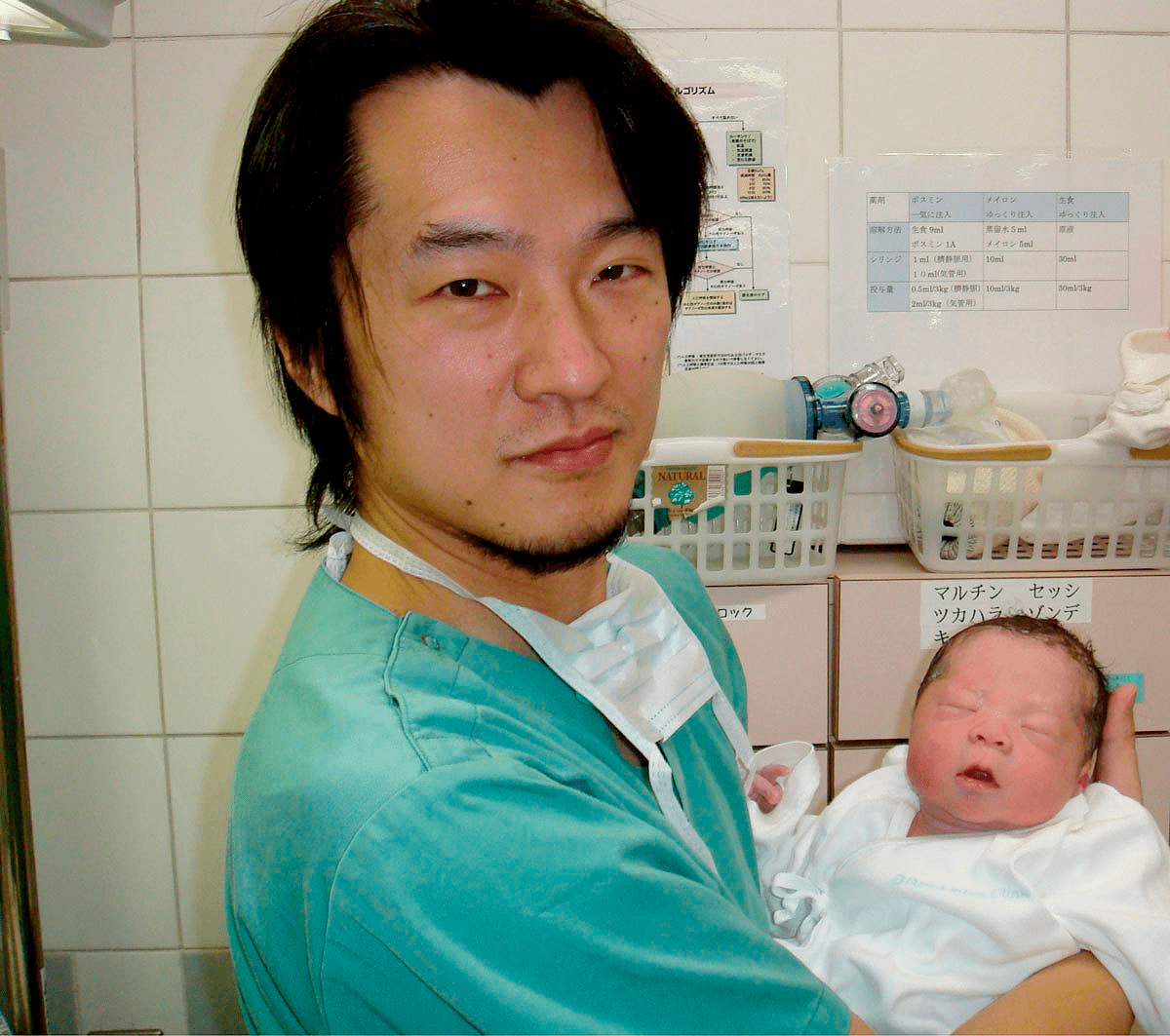
Рисунок 6. Казухиро Кавамура (Kazuhiro Kawamura) — один из ученых, участвовавший в исследовании — держит на руках новорожденного мальчика, которого родила первоначально бесплодная женщина
Мнения и прогнозы
По мнению Марчелле Цедарса (Marcelle Cedars) — специалиста в области репродуктивной онкологии из Университета Калифорнии в Сан-Франциско — исследователи поторопились апробировать новый метод лечения бесплодия на человеке: «Ученые продемонстрировали рождение здорового потомства при проведении предварительных исследований на мышах, но не было получено доказательств роста, развития и/или плодовитости этого поколения» [12].
Авторы исследования полагают, что метод подходит бесплодным женщинам среднего возраста, а также тем, кому диагностировали первичную недостаточность яичников, вследствие которой в более чем 50% случаев беременность не наступает. Однако не все эксперты разделяют их оптимизм. Руководитель врачебной группы, изучающей оплодотворение, из Университета Южной Калифорнии Ричард Паульсон (Richard Paulson) убежден, что ключевое условие эффективности разработанного механизма лабораторной «активации» фолликула — наличие в нем здоровой яйцеклетки. Кроме того, Паульсон заостряет внимание на том, что неразумно сопоставлять результаты лечения женщины в возрасте 29 лет с результатами лечения женщины в 40 лет, поскольку гормональная стимуляция роста и развития фолликулов в разные возрастные периоды происходит с различной интенсивностью.
Рассмотренный консервативный метод стимуляции овуляции путем блокировки сигнального пути Hippo в отдельных фрагментах ткани яичников может быть полезен женщинам, больным раком или проходящим процедуры стерилизации. Но все же главное достижение ученых — это рождение ребенка у женщины, которая без их участия никогда не смогла бы стать матерью.
https://biomolecula.ru/articles/proryv-v-lechenii-besplodiia
